🎃整膜不整膜的问题:
现在有些杂志社都要求wb提供整膜,也就是一个figure的所有条带必须在一张膜上,之前了解到了nature子刊,还有一些别的一区top文章并没有这个要求。
对于这个是否整膜,是否裁膜,我是这么做的:
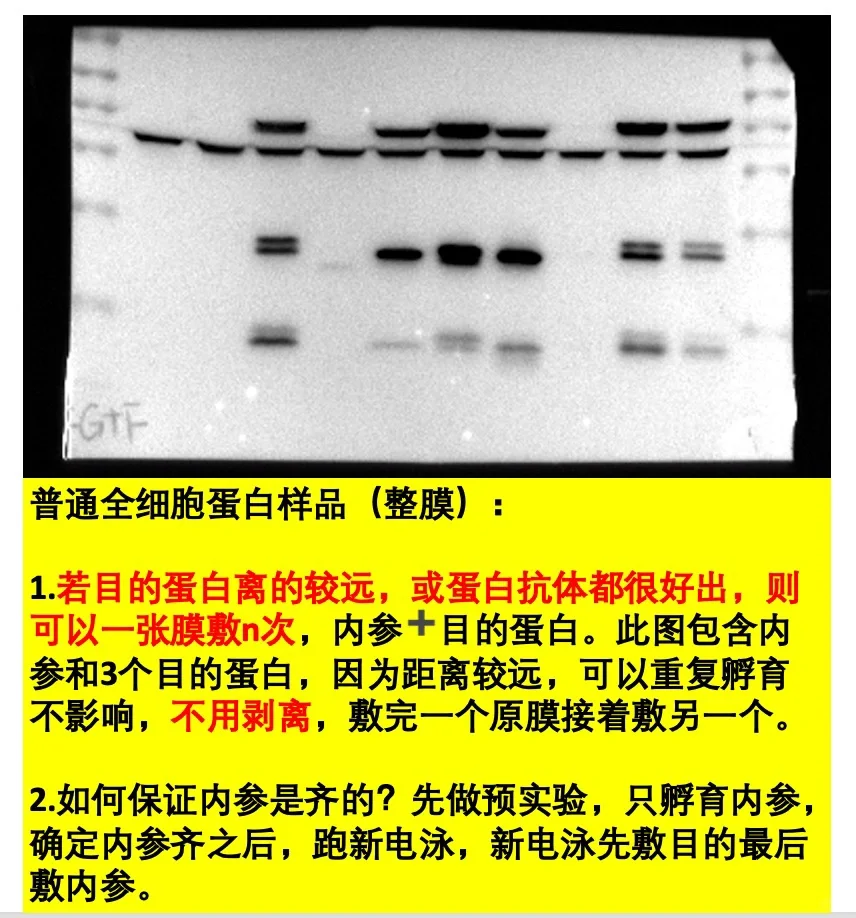
✅1.特别好出的蛋白,很好用的抗体,我会用整膜敷n个蛋白。分为两种情况:
🎃第一种:用stripping buffer剥离蛋白,此方法用于蛋白很好出,但是位置又相差很近,无法同时孵育的情况。(个人比较少用蛋白剥离液,目前没有用到过让我觉得特别好用的,如果剥离效果不好我可能就会直接裁膜孵育。
🎃第二种:直接孵育。敷完一个曝光,不用洗,直接敷另外一个。此方法用于蛋白很好出,且位置相差较远,互不影响的情况。ps:内参和标签抗体(Flag,HA,Myc等等)可以同时孵育,配一管抗体,含内参一抗和标签一抗🏷️
2.不好出的蛋白,裁膜孵育。
注意事项:
1.一条marker要保留完整,不要把marker一分为二当作两个marker,这样不好看清楚。
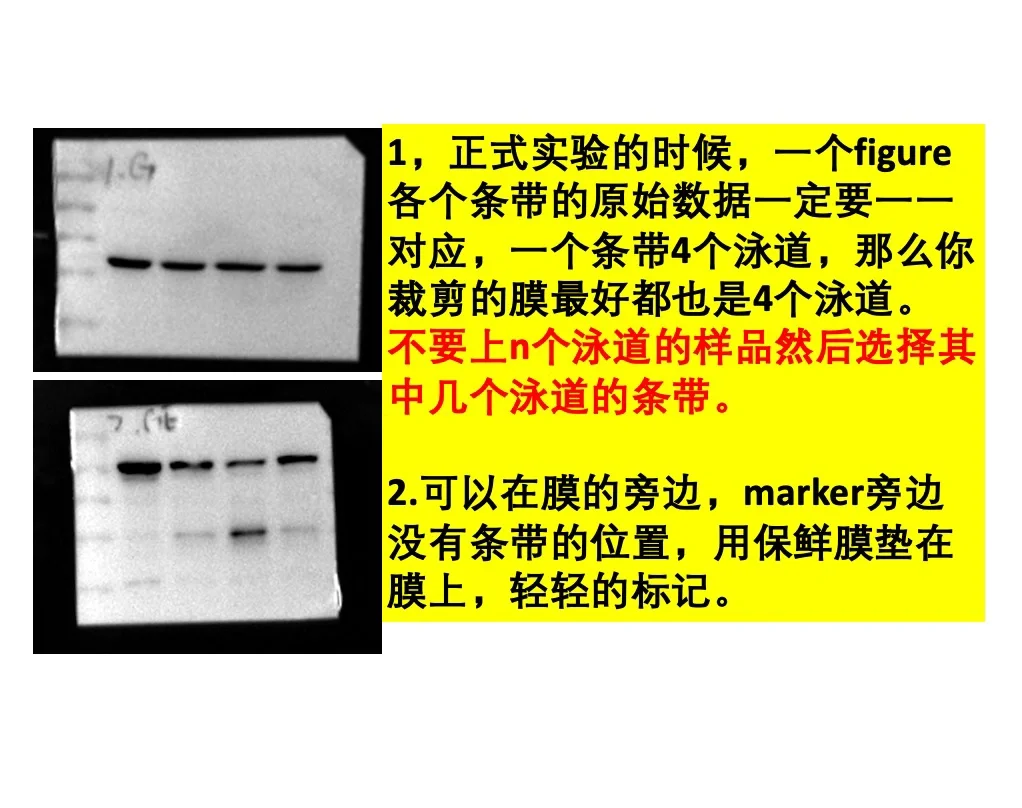
2.一个条带至少原图要保留2个marker以上,最好保留3~4条marker。
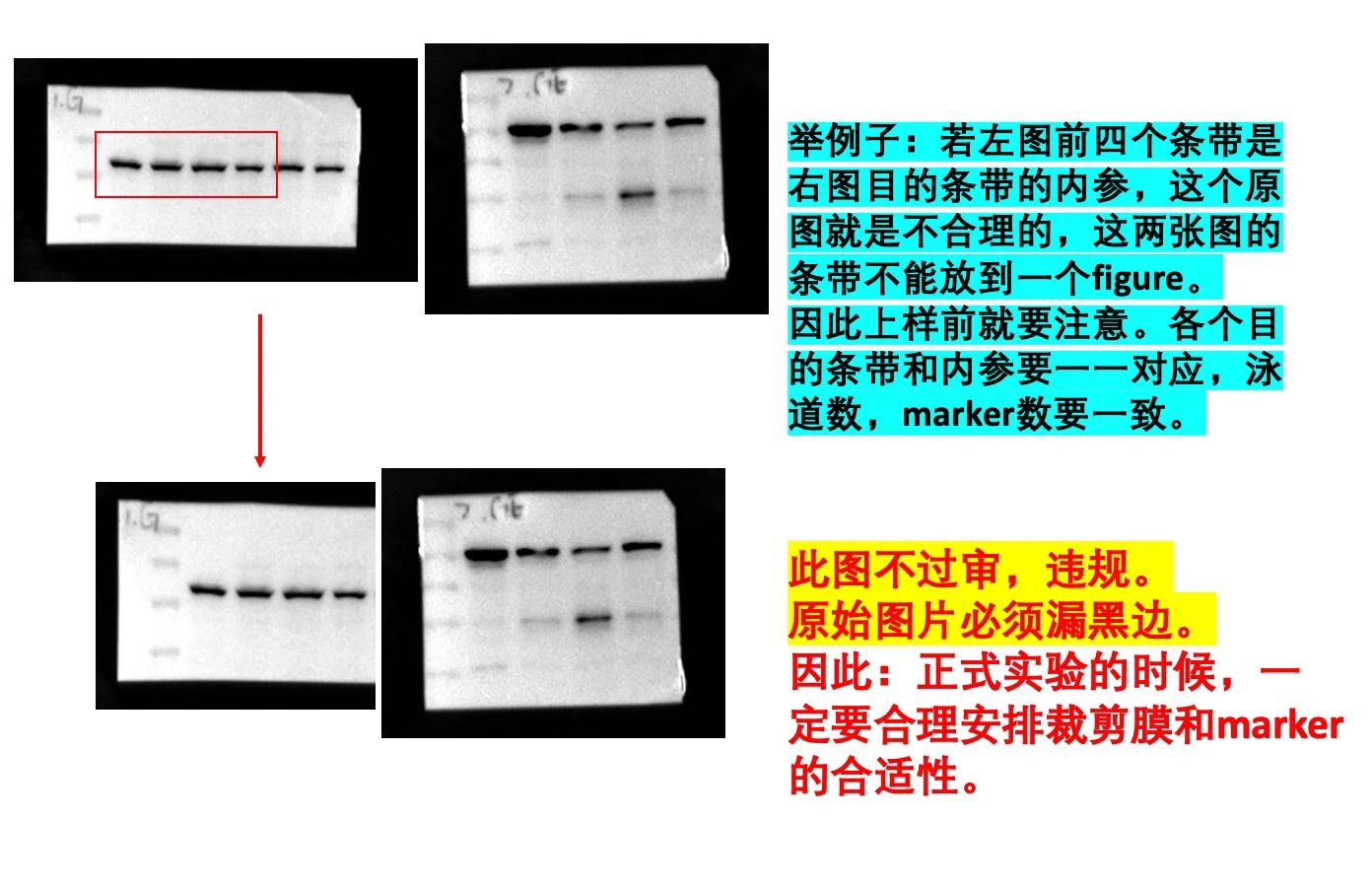
3.一个figure里的目的蛋白和内参蛋白,原始数据要一一对应,尤其是泳道的多少。
4.可以在marker旁边没有蛋白的位置做简略的标记,不影响,且很多杂志都比较喜欢这样有标记的原图。
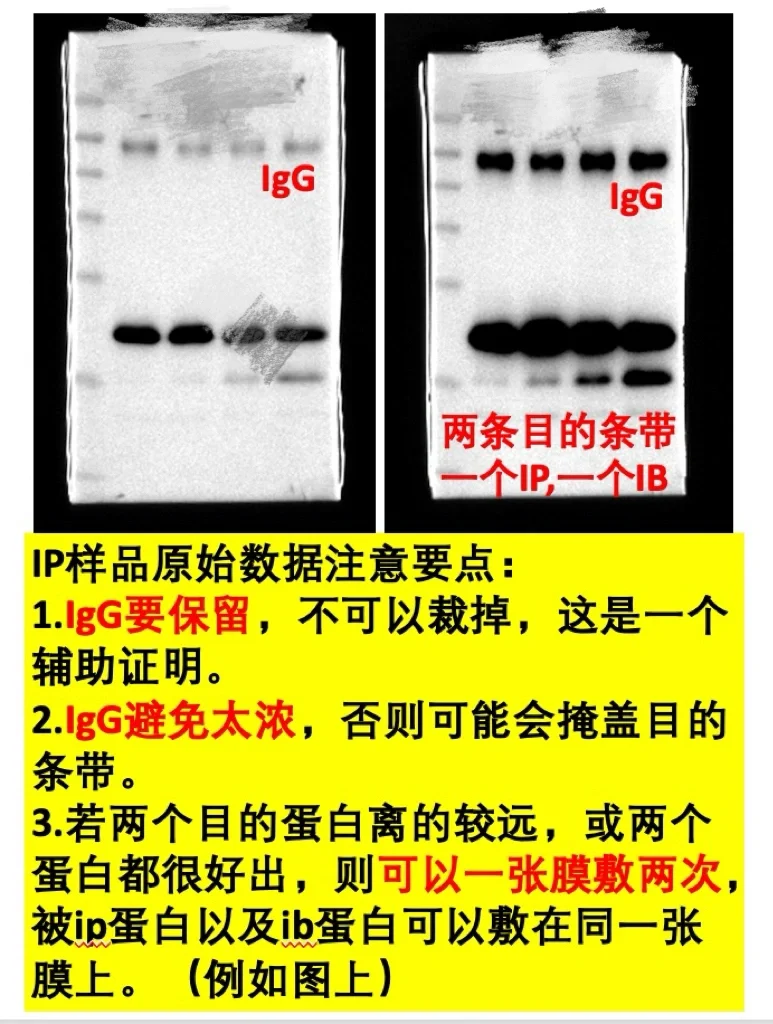
✅3.免疫共沉淀原图
1.被ip蛋白如果离IgG较远,不要裁掉,最好保留igG。
2.若ip A蛋白,检测B蛋白,B蛋白比较好出的话,可以一张膜孵育A和B,若不好出,可以分开孵育。
3.避免IgG过浓的情况,容易掩盖目的蛋白,尤其是距离较近的情况下。